Учет налогов на заработную плату в смете
Согласно Методике определения сметной стоимости в строительстве, стоимость работ в смете может включать прямые затраты, накладные расходы и сметную прибыль. (ПЗ+НР+СП),
Заработная плата строителей — учтена в составе прямых затрат. (ПЗ=ОЗП+МР+ЭМ)
Накладные расходы (НР) рассчитываются в процентах от фонда оплаты труда, который состоит включает в себя основную заработную плату и заработную плату механизаторов (ФОТ= ОЗП+ЗПМ)
В Методических указаниях по определению величины накладных расходов в строительстве (МДС 81-33.2004), утвержденных Постановлением Госстроя России от 12 января 2004 г. N 6, приведена постатейная структура накладных расходов /приложение 8/
-Статья накладных расходов под N 2.2- это отчисления на ЕСН от оплаты труда рабочих,
-Статья накладных расходов под N 2.4 — это расходы на охрану труда и технику безопасности (иначе говоря, взносы по обязательному социальному страхованию от несчастных случаев на производстве).
Таким образом, при составлении смет заработная плата строителей включается в состав прямых затрат, а страховые отчисления (ЕСН и взносы от несчастных случаев на производстве) — в состав накладных расходов.
А где же НДФЛ?
Разберемся поподробнее:
НДФЛ (Налог на доходы физических лиц) представляет собой индивидуальный безвозмездный платеж.
Составляет он 13% от суммы, полученной от любого дохода. (!)
Налог оплачивается физическим лицом с его доходов.
Ответственность за неуплату налога лежит на физическом лице.
Сейчас работодатель берет на себя обязательства и перечисляет НДФЛ за своего работника.
Исходя из вышеперечисленного, мы видим, что в прямых затратах учтена заработная плата с учетом НДФЛ, т.е. именно начисленная заработная плата.
Подводим итог.
Заработная плата+ НДФЛ учтены в ФОТ
ЕСН, взносы по обязательному социальному страхованию от несчастных случаев на производстве учтены в НР
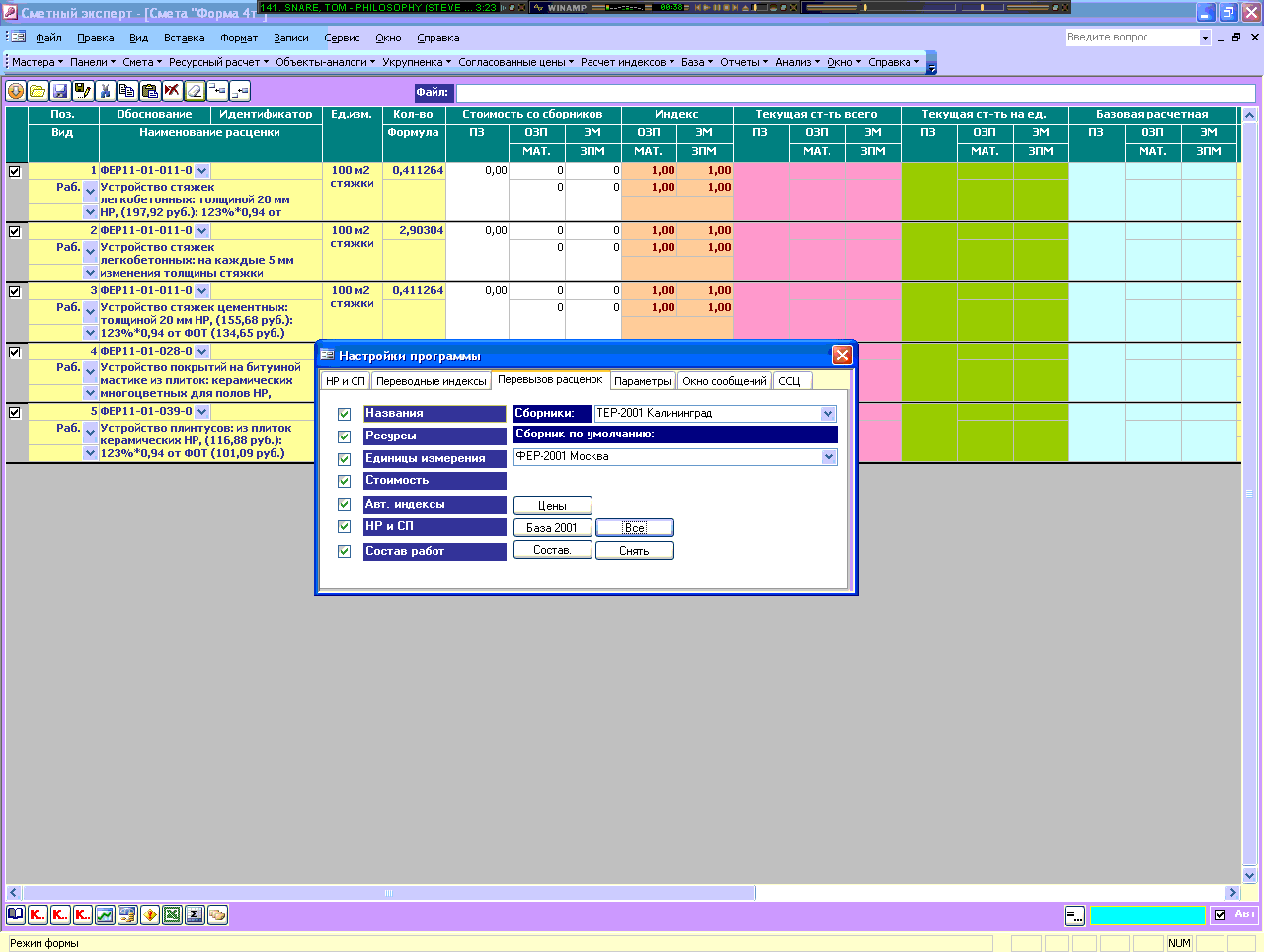
встроенные идентификаторы для расчёта лимитированных затрат в смете
Для вычисления лимитированных затрат в программном комплексе ГРАНД-Смета наряду с конкретными числовыми значениями также можно указывать формулы, используя в этих формулах ряд 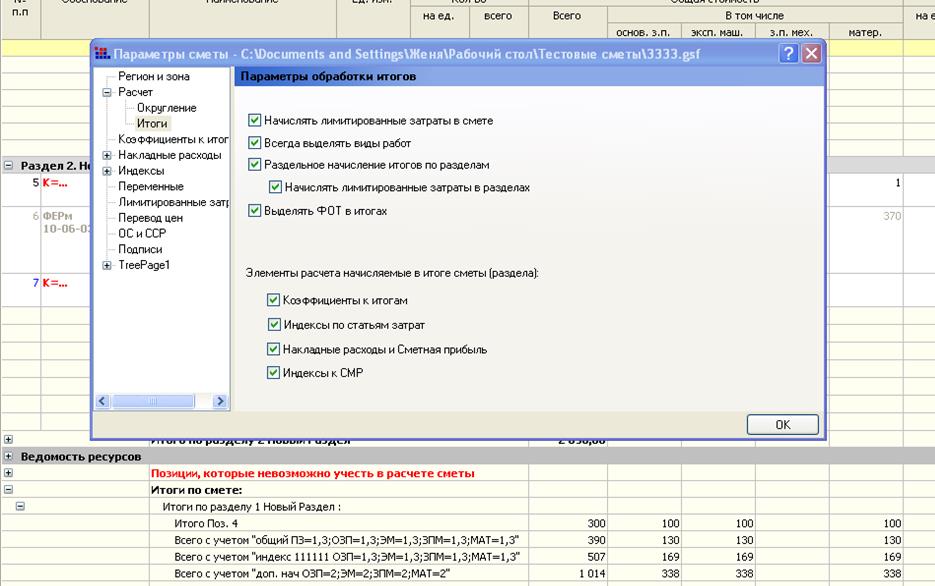 Каждый идентификатор обозначает тот или иной элемент сметного расчёта.
Каждый идентификатор обозначает тот или иной элемент сметного расчёта.
Ниже перечислены все имеющиеся в программном комплексе встроенные идентификаторы:
| ВСЕГО | Стоимость сметы до расчёта лимитированных затрат |
| С или СР | Стоимость строительных работ по смете |
| М или МР | Стоимость монтажных работ по смете |
| СМР | Стоимость СМР по смете = сумма строительных и монтажных работ |
| О или ОБ | Стоимость оборудования по смете |
| П или ПР | Стоимость прочих работ по смете |
| ФОТ | Фонд оплаты труда по смете |
| ОЗП | Основная заработная плата (заработная плата рабочих) по смете |
| ЭМ | Стоимость эксплуатации машин по смете |
| ЗПМ | Заработная плата машинистов по смете |
| МАТ | Стоимость материалов по смете |
| ТЗ | Трудозатраты рабочих по смете |
| ТЗМ | Трудозатраты машинистов по смете |
| НР | Сумма накладных расходов, рассчитанных «стандартным» образом |
| СП | Сумма сметной прибыли, рассчитанной «стандартным» образом |
| НРЗПМ | Сумма накладных расходов, рассчитанных от ЗПМ (используется только при расчёте по методике ТСН) |
| СПЗПМ | Сумма сметной прибыли, рассчитанной от ЗПМ (используется только при расчёте по методике ТСН) |
| НРВСЕГО | Сумма НР + НРЗПМ |
| СПВСЕГО | |
| ЗУ | Сумма зимнего удорожания, рассчитанного по индивидуальным нормативам для разных работ в смете (закладка Лимит. затраты – Зимниев параметрах сметы) затраты – Зимниев параметрах сметы) |
| ВОЗВРАТ | Стоимость возвратных материалов по смете |
| МАТЗАК | Стоимость материалов заказчика по смете |
Для получения значения любого элемента сметного расчёта из конкретного раздела локальной сметы необходимо вначале написать
Значения всех идентификаторов возвращаются в зависимости от того, какой способ расчёта задан в данный момент для локальной сметы – базисно-индексный или ресурсный.
Но в ПК «ГРАНД-Смета» также предусмотрена возможность добавить к идентификатору дополнительный квалификатор методики расчёта, чтобы получить нужное значение независимо от текущих настроек сметы: БЦ – расчёт в базисных ценах без учёта индексов, БИМ – расчёт в текущих ценах базисно-индексным методом в соответствии с настройкой индексов в смете,
Благодаря этому появилась возможность, например, при составлении локальной сметы базисно-индексным методом посчитать заработную плату рабочих и стоимость эксплуатации машин стандартным образом с использованием индексов, а стоимость материалов взять по ресурсному расчёту сразу в текущих ценах – для этого необходимо в основном расчёте стоимость материалов обнулить, после чего добавить в список лимитированных затрат строку со значением  МАТ.
МАТ.
Применение норм накладных расходов и сметной прибыли при расчете ФОТ по табелю
Вопрос:
Как обосновать заказчику применение накладных расходов и сметной прибыли к работам по фактическим трудозатратам (табель). Заказчик возражает против начисления накладных и сметной прибыли от ФОТ.
Светлана
s***********[email protected]
Ответ:
Величина накладных расходов в строительстве определяется по МДС 81-33.2004, величина сметной прибыли по МДС 81-25.2001
Данный способ применим в случаях расчета сметной стоимости по сборникам ГЭСН, ФЕР и ТЕР. Расчет сметной стоимости, с учетом НР и СП, в сметных программах обычно происходит автоматически.
Если вы рассчитываете сметную стоимость по фактическим трудозатратам (табелю), по всей видимости — в текущим уровне цен, то нужно уточнить какая принимается стоимость человеко-часа, на основании чего она принята и, главное, согласована ли с заказчиком.
Когда вы убедитесь, что в расчете использована стоимость человеко-часа, подтвержденная документом регионального уровня (лучше письма вашего регионального центра ценообразования в строительстве, или в Республике Башкортостан, например, публикуемые периодически приказы Госстроя, в которых указывается месячный уровень оплаты труда работников IV разряда) то можно аргументировать заказчику тем, что накладные расходы и сметная прибыль в ФОТ не учтены и поэтому должны быть рассчитаны отдельно по видам работ, согласно МДС 81-33.2004 «Методические указания по определению величины накладных расходов в строительстве» и МДС 81-25.2001 «Методические указания по определению величины сметной прибыли в строительстве». А в МДС 81-33.2004 и МДС 81-25.2001 выберите наиболее подходящие виды работ.
Конечно, чтобы избежать подобной проблемы, лучше согласовывать порядок расчета сметной стоимости с заказчиком заранее.
Если же такой порядок не был согласован, то разрабатывать сметную документацию по сборникам ФЕР или сборникам ГЭСН, при необходимости в ресурсном методе расчета, чтобы вопросы о наличии в смете НР и их величине не поднимались.
Определение и расчет pH — Химия LibreTexts
pH водного раствора является мерой его кислотности или щелочности. PH водного раствора можно определить и рассчитать, используя концентрацию иона гидроксония в растворе.
Введение
Значение pH водного раствора основано на шкале pH, которая обычно находится в диапазоне от 0 до 14 в воде (хотя, как обсуждается ниже, это не формальное правило). PH 7 считается нейтральным.{-14} \).
- pH : Термин pH относится к «потенциалу иона водорода». Он был предложен датским биохимиком Сореном Соренсеном в 1909 году, чтобы мог быть более удобный способ описания концентраций гидроксония и гидроксид-иона в водных растворах, поскольку обе концентрации имеют тенденцию быть чрезвычайно малыми. Соренсен определил pH как отрицательное значение \ логарифма концентрации ионов водорода. С точки зрения концентрации иона гидроксония уравнение для определения pH водного раствора: \ [pH = — \ log [H_ {3} O ^ +] \]
- pOH : pOH водного раствора, который связан с pH, может быть определен следующим уравнением: \ [pOH = — \ log [OH ^ -] \] В этом уравнении используется концентрация гидроксида в водном растворе.
 -] = 1.{-14} \)
-] = 1.{-14} \)\ (pK_w = pH + pOH = 14 \).
Сильные кислоты и сильные основания
Ионизация сильных кислот и сильных оснований в разбавленных водных растворах практически полностью завершена. В водных растворах сильных кислот и сильных оснований самоионизация воды происходит лишь в небольшой степени. Поскольку это происходит лишь в небольшой степени, самоионизация воды является незначительным источником ионов гидроксония и гидроксида. Зная это, при расчете концентрации гидроксония в водном растворе сильной кислоты мы можем сказать, что сильная кислота является основным источником ионов гидроксония.Мы также можем сказать, что при расчете концентрации гидроксида в водном растворе сильного основания сильное основание является основным источником гидроксид-ионов. Обычно это верно, если только растворы сильных кислот и сильных оснований не сильно разбавлены.
Слабые кислоты и слабые основания
Слабые кислоты только частично диссоциируют в водных растворах и достигают состояния равновесия, поэтому степень их диссоциации определяется уравнением равновесия для этой кислоты в растворе:
\ [K_a = \ dfrac {[H_ {3} O ^ +] [A ^ -]} {[HA]} \]
с
- \ ([H_ {3} O ^ +] \) — концентрация гидроксония
- \ ([A ^ -] \) — концентрация сопряженных оснований
- \ ([HA] \) — концентрация слабой кислоты
Слабые основания также лишь частично диссоциируют в водных растворах и достигают состояния равновесия.
 +] = Ион \]
+] = Ион \]\ [[B] = Слабая \; База \]
Список литературы
- Петруччи, Ральф Х., Херринг, Гоффри Ф., Мадура, Джеффри Д. и Биссоннетт, Кэри. Общая химия: принципы и современные приложения . 10-е изд. Нью-Джерси: Pearson Canada, 2011.
- Кольб, Дорис. Концепция pH . J. Chem. Educ. , 1979, 56 (1), p 49. Январь 1979. DOI Link: 10.1021 / ed056p49
Проблемы
- Решение — 0.-] \) и уравнение pK w \ (pK_w = pH + pOH = 14 \).
0,0035 M LiOH, LiOH — сильное основание
[OH — ] = 3,5 X 10 -3
pOH = — \ log (3,5 X 10 -3 ) = 2,46
Теперь решите для pH:
pH = 14 — pOH
pH = 14 — 2,46 = 11,54
4. 0,0045 M плавиковая кислота, плавиковая кислота — слабая кислота.
Используйте K уравнение \ (K_a = \ dfrac {[H_ {3} O ^ +] [A ^ -]} {[HA]} \) и таблицу ICE.
 -] [B +]} {[B]} \) и таблица ICE.
-] [B +]} {[B]} \) и таблица ICE.Авторы и авторство
Вот как рассчитать значения pH
pH — это показатель кислотности или щелочности химического раствора. Шкала pH варьируется от 0 до 14 — значение семь считается нейтральным, менее семи — кислым, а более семи — основным.
pH — это отрицательный десятичный логарифм («логарифм» на калькуляторе) концентрации ионов водорода в растворе. Чтобы вычислить его, возьмите логарифм данной концентрации ионов водорода и поменяйте знак местами.См. Дополнительную информацию о формуле pH ниже.
Вот более подробный обзор того, как рассчитать pH и что означает pH в отношении концентрации ионов водорода, кислот и оснований.
Обзор кислот и оснований
Существует несколько способов определения кислот и оснований, но pH конкретно относится только к концентрации ионов водорода и применяется к водным (на водной основе) растворам. Когда вода диссоциирует, она дает ион водорода и гидроксид.
 См. Это химическое уравнение ниже.
См. Это химическое уравнение ниже.H 2 O ↔ H + + OH —
При расчете pH помните, что [] относится к молярности, M. Молярность выражается в единицах молей растворенного вещества на литр раствора. Если вам дана концентрация в любых единицах, отличных от молей (массовый процент, молярность и т. Д.), Преобразуйте ее в молярность, чтобы использовать формулу pH.
Связь между pH и молярностью можно выразить как:
K w = [H + ] [OH — ] = 1×10 -14 при 25 ° C
для чистой воды [H + ] = [OH — ] = 1×10 -7Как рассчитать pH и [H +]
Уравнение равновесия дает следующую формулу для pH:
pH = -log 10 [H + ]
[H + ] = 10 -pHДругими словами, pH — это отрицательный логарифм молярной концентрации ионов водорода или молярная концентрация ионов водорода, равная 10 в степени отрицательного значения pH.
 Этот расчет легко выполнить на любом научном калькуляторе, потому что чаще всего на нем есть кнопка «журнал». Это не то же самое, что кнопка «ln», которая относится к натуральному логарифму.
Этот расчет легко выполнить на любом научном калькуляторе, потому что чаще всего на нем есть кнопка «журнал». Это не то же самое, что кнопка «ln», которая относится к натуральному логарифму.pH и pOH
Вы можете легко использовать значение pH для расчета pOH, если помните:
pH + pOH = 14
Это особенно полезно, если вас просят определить pH основания, поскольку вы обычно решаете pOH, а не pH.
Пример задачи расчета
Попробуйте эти примеры задач, чтобы проверить свои знания о pH.
Пример 1
Рассчитайте pH для конкретного [H + ]. Рассчитайте приведенный pH [H + ] = 1,4 x 10 -5 M
Ответ:
pH = -log 10 [H + ]
pH = -log 10 (1,4 x 10 -5 )
pH = 4,85Пример 2
Рассчитайте [H + ] исходя из известного pH. Найдите [H + ], если pH = 8,5.

Ответ:
[H + ] = 10 -pH
[H + ] = 10 -8.5
[H + ] = 3,2 x 10 -9 MПример 3
Найдите pH, если концентрация H + составляет 0,0001 моль на литр.
Здесь полезно переписать концентрацию как 1,0 x 10 -4 M, потому что это дает формулу: pH = — (- 4) = 4. Или вы можете просто использовать калькулятор для записи журнала. Это дает вам:
Ответ:
pH = — log (0,0001) = 4
Обычно вам не задают концентрацию ионов водорода в задаче, но нужно определить ее по химической реакции или концентрации кислоты.Простота этого будет зависеть от того, какая у вас кислота — сильная или слабая. Большинство проблем с pH связаны с сильными кислотами, потому что они полностью диссоциируют на ионы в воде. С другой стороны, слабые кислоты диссоциируют только частично, поэтому в равновесии раствор содержит как слабую кислоту, так и ионы, на которые она диссоциирует.

Пример 4
Найдите pH 0,03 М раствора соляной кислоты HCl.
Помните, соляная кислота — это сильная кислота, которая диссоциирует в молярном соотношении 1: 1 на катионы водорода и анионы хлорида.Итак, концентрация ионов водорода точно такая же, как концентрация раствора кислоты.
Ответ:
[H + ] = 0,03 M
pH = — log (0,03)
pH = 1,5Проверьте свою работу
Выполняя расчеты pH, всегда проверяйте, чтобы ваши ответы были разумными. Кислота должна иметь pH намного меньше семи (обычно от одного до трех), а щелочь должна иметь высокое значение pH (обычно около 11-13).Хотя теоретически можно рассчитать отрицательный pH, на практике значения pH должны находиться в пределах от 0 до 14. Это означает, что pH выше 14 указывает на ошибку либо в настройке расчета, либо в самом расчете.
Источники
- Covington, A.K .; Bates, R.G .; Дерст, Р. А. (1985).
 «Определения шкал pH, стандартных эталонных значений, измерения pH и соответствующей терминологии». Pure Appl. Chem . 57 (3): 531–542. DOI: 10.1351 / pac198557030531
«Определения шкал pH, стандартных эталонных значений, измерения pH и соответствующей терминологии». Pure Appl. Chem . 57 (3): 531–542. DOI: 10.1351 / pac198557030531 - Международный союз чистой и прикладной химии (1993). Величины, единицы и символы в физической химии (2-е изд.) Оксфорд: Blackwell Science. ISBN 0-632-03583-8.
- Mendham, J .; Denney, R.C .; Barnes, J.D .; Томас, М. Дж. К. (2000). Количественный химический анализ Фогеля (6-е изд.). Нью-Йорк: Прентис-Холл. ISBN 0-582-22628-7.
Как рассчитать pH в химии
Внимание: Этот пост был написан несколько лет назад и может не отражать последние изменения в программе AP®.Мы постепенно обновляем эти сообщения и удалим этот отказ от ответственности после обновления этого сообщения. Спасибо за ваше терпение!
Реферат: pH — единица измерения, часто используемая в фундаментальных концепциях химии. В статье «Как рассчитать pH» объясняются категории, которые имеет научная математика и роль pH в нашей жизни.

Условия для ознакомления:
- pH
- pOH
- Ион водорода
- Ион гидроксида
- Кислота
- База
Термин «pH» является аббревиатурой от «потенциала водорода.«PH — это единица измерения, которая представляет концентрацию ионов водорода в растворе. Эта единица измерения была введена биохимиком Сёреном Петером Лаурицем Соренсеном в 1909 году. Это был простой способ представить концентрацию ионов водорода в растворе во время титрования. Когда кислота или основание добавляются к воде, это соединение диссоциирует на ионы. Для кислот одним из этих ионов является ион водорода (H + ), а для оснований одним из ионов является ион гидроксида (OH — ). Это описание кислот и оснований известно как теория Аррениуса.Концентрация ионов водорода часто описывается шкалой pH как числовое значение.
Шкала pH: кислая, нейтральная и основнаяШкала pH описывает кислотность раствора: кислая, нейтральная или основная.
 Раствор с pH менее 7 — это кислота, ровно 7 — нейтральный раствор, а более 7 — основание. Основания содержат меньше ионов водорода, но больше гидроксид-ионов, представленных pOH или «потенциалом гидроксид-ионов».
Раствор с pH менее 7 — это кислота, ровно 7 — нейтральный раствор, а более 7 — основание. Основания содержат меньше ионов водорода, но больше гидроксид-ионов, представленных pOH или «потенциалом гидроксид-ионов».Таблица 1. Шкала pH
Кислый нейтральный Базовый Менее 7 7 Больше 7 Многие другие ученые изучали свойства кислот и оснований на основе идей Соренсена и Аррениуса и пришли к своим собственным определениям.Известная теория известна как теория Бронстеда-Лоури. Теория Бренстеда-Лоури — это концепция, включающая кислоту и основания, которая предполагает, что кислоты действуют как доноры протонов. Поскольку нейтральные атомы водорода обычно состоят из одного протона и одного электрона, положительный ион водорода часто называют протоном. Эти протоны несут положительный заряд и передаются основаниям.
 Основания, согласно этой логике, являются акцепторами протонов. Основания, несущие неподеленные пары электронов, притягивают положительные ионы водорода (протоны).
Основания, согласно этой логике, являются акцепторами протонов. Основания, несущие неподеленные пары электронов, притягивают положительные ионы водорода (протоны).В лаборатории pH можно определить с помощью индикатора pH, такого как pH-бумага. pH-бумага обычно содержит слабую кислоту или слабое основание, которые реагируют изменением цвета при определенном pH. Этот метод часто используется как дешевый и быстрый способ определения pH вместо использования pH-метров, которые требуют частой калибровки и обслуживания. Имейте в виду, что растворы с очень низким или очень высоким значением pH могут быть очень едкими, и с ними следует обращаться осторожно.
Источник изображения: FlickrПрактические проблемы
Определите, является ли следующий раствор кислотным, нейтральным или основным.
- pH = 1,00
- pH = 10,00
- pH = 6,99
- pH = 7,02
- pH = 8,00
- pH = 13,00
- pH = 2,00
Ответы:
- Кислый
- Базовый
- нейтральный
- нейтральный
- Базовый
- Базовый
- Кислый
Концентрация — это количество растворенного вещества по отношению к общему количеству раствора.
 Высокое количество растворенного вещества соответствует высокой концентрации, а меньшее количество растворенного вещества соответствует низкой общей концентрации.
Высокое количество растворенного вещества соответствует высокой концентрации, а меньшее количество растворенного вещества соответствует низкой общей концентрации.Когда кислота или основание помещают в растворитель, это соединение распадается на ионы. Концентрация H + (ионы водорода) в растворе будет определять кислотность или основность раствора. Высокая концентрация H + будет означать кислый раствор, а низкая концентрация H + будет означать щелочной раствор.
Например, в соляной кислоте (обычная кислота, которая представляет собой водный раствор HCl) молекулы HCl диссоциируют на два типа ионов, H + и Cl — . Эта диссоциация дает высокую концентрацию H + , которая является свойством кислого раствора.
То же самое можно увидеть в базовых растворах с низкой концентрацией H + из-за высокой
OH — (гидроксид-ион). Например, когда NaOH (гидроксид натрия, обычное основание) помещается в воду, он диссоциирует на два типа ионов: Na + и OH —.
 Высокая концентрация OH — , соответствующая низкой концентрации H + , является свойством основного раствора.
Высокая концентрация OH — , соответствующая низкой концентрации H + , является свойством основного раствора.Таблица 2. Связь между pH и pOH
Концентрация H + Концентрация -ОН Примеры Кислота Высокая Низкий HCl, HCOOH, HNO 3 База Низкий Высокая NaOH, MgO, CaCO 3 Нейтраль Равно OH — Равно H + Вода Определение pH и pOH будет рассчитываться с использованием концентрации ионов водорода и гидроксид-ионов соответственно.pH и pOH также взаимосвязаны, поэтому, если у вас недостаточно информации для определения одного, вы можете использовать концентрацию другого.
 {+} right]} = log (0.100) = 1,00
{+} right]} = log (0.100) = 1,00Значение pH 1,00 указывает на очень кислый раствор.
В примерах 1 и 2 мы можем использовать концентрацию кислоты как концентрацию иона H + , потому что каждая молекула кислоты диссоциирует, тем самым высвобождая ион H + . Эти типы кислот называют «сильными кислотами». Для «слабых кислот» большинство молекул кислоты не диссоциирует, поэтому нам пришлось бы использовать более сложные методы для расчета pH для растворов слабых кислот. В этой статье мы остановимся на сильных кислотах и основаниях, а в другой — рассмотрим слабые кислоты и основания.{-pOH}
pOH — это другой способ описания кислотности и основности, поэтому будьте осторожны, не смешивайте его с pH. Описания растворов по шкале pOH приведены в таблице 2.
Таблица 3. Шкала pOH
Базовый нейтральный Кислый Менее 7 7 Больше 7 Определение концентрации гидроксид-ионов и pOH будет позже использовано, чтобы показать взаимосвязь между pH и pOH.
Рассчитайте зависимость между pH и pOH {-12}
{-12}В разделе «Концентрации H + и OH — » мы обсуждали, что высокая концентрация гидроксид-ионов оставляет мало места для ионов водорода и наоборот. Соотношение pH и pOH таково, что оба значения будут равны 14,00. Это можно представить в виде следующего уравнения:
pH + pOH = 14,00
Вы можете проверить свою работу, сложив pH и pOH, чтобы получить результат 14.00. Это также превосходное представление концепции нейтральности pH, где равные концентрации [H + ] и [OH — ] приводят к тому, что и pH, и pOH равны 7.
pH + pOH = 14,00
pH = 14-pOH
pH = 14-pH
Пример 1. Каков pH раствора с pOH 12,40?Имейте в виду, что соотношение pH и pOH равно 14.
pH + pOH = 14,00
рОН = 12,40
pH = неизвестно
pH +12.40 = 14,00
pH = 1,60
Проверьте свою работу: 1,60 + 12,40 = 14,00
Пример 2: Каков pOH раствора, который имеет [H + ] 0,100 M HCl?Сначала определите pH и используйте это значение вместе с соотношением pH и pOH.

pH + pOH = 14,00
pH = -log [0,1000] = 1,00
1,00 + pOH = 14,00
рОН = 13,00
Проверьте свою работу: 1.00 + 13.00 = 14.00
Пример 3: Что такое pOH раствора с pH 3.40?Имейте в виду, что соотношение pH и pOH равно 14,00.
pH + pOH = 14,00
pH = 3,40
pOH = неизвестно
рОН + 3,40 = 14,00
pOH = 10,60 = pH 10,60
Проверьте свою работу: 10,60 + 3,40 = 14,00
Важность pHpH окружает нас повсюду. Важно, чтобы жизненно важные растворы, такие как вода, желудочная кислота и кровь, поддерживали постоянный pH. Вода с нейтральным pH около 7 определяет растворимость многих соединений.Без соответствующего pH воды многие химические реакции не произошли бы. Это также можно увидеть по естественным явлениям, таким как кислотный дождь. Сильно кислые осадки могут вызвать эрозию и другие опасные экологические последствия.
Источник изображения: EPApH играет важную роль в растворах в организме человека.
 Конкретные значения pH имеют жизненно важное значение для таких растворов, как слюна, желудочная кислота и кровь. Выработка слюны во рту называется первым этапом пищеварения.Во всем пищеварительном тракте пища должна расщепляться кислыми растворами. Для начала этого процесса важно, чтобы pH слюны был в пределах 6,5-7,5, слегка кислый. Позже желудочная кислота также действует в пищеварительной системе. Важно, чтобы желудочная кислота имела очень кислый pH в диапазоне от 1,5 до 3,5 из-за секреции HCl и высокой концентрации ионов водорода. Эта сильнокислая среда ускоряет пищеварение и начинает расщеплять частицы пищи, готовясь к процессу выделения.
Конкретные значения pH имеют жизненно важное значение для таких растворов, как слюна, желудочная кислота и кровь. Выработка слюны во рту называется первым этапом пищеварения.Во всем пищеварительном тракте пища должна расщепляться кислыми растворами. Для начала этого процесса важно, чтобы pH слюны был в пределах 6,5-7,5, слегка кислый. Позже желудочная кислота также действует в пищеварительной системе. Важно, чтобы желудочная кислота имела очень кислый pH в диапазоне от 1,5 до 3,5 из-за секреции HCl и высокой концентрации ионов водорода. Эта сильнокислая среда ускоряет пищеварение и начинает расщеплять частицы пищи, готовясь к процессу выделения.Здоровая кровь имеет pH 7,4. В кровотоке происходят сотни реакций, например, ферментов, для которых требуется определенный pH. Кровь с более высоким или низким pH может вызвать негативные симптомы. Ацидоз — это симптом состояния, при котором значение pH крови слишком низкое, а алкалоз указывает на кровь со слишком высоким значением pH.

Люди — не единственные организмы, которые зависят от соответствующего уровня pH. Некоторые виды процветают только в щелочной (основной) среде и не могут выжить в нейтральной или кислой среде.Целые экосистемы вращаются вокруг pH.
Вопросы к обсуждению- Почему так важно, чтобы океаны поддерживали определенный pH?
- Назовите некоторые предметы домашнего обихода с базовым уровнем pH.
- Что такое pH уксуса? Почему?
- Если пациент страдает ацидозом, чем он страдает?
- Какую роль играет pH в крови?
More с pH: Кислотно-основное равновесие, титрование, буферы, pKa, константа равновесия, нейтрализация, конъюгированные кислоты, основание конъюгата.
Ищете химическую практику?Ознакомьтесь с другими нашими статьями по химии.
Вы также можете найти тысячи практических вопросов на Albert.io. Albert.io позволяет настроить процесс обучения так, чтобы он ориентировался на практику там, где вам больше всего нужна помощь.
 Мы зададим вам сложные практические вопросы, которые помогут вам достичь мастерства в химии.
Мы зададим вам сложные практические вопросы, которые помогут вам достичь мастерства в химии.Начните практиковать здесь .
Вы преподаватель или администратор, заинтересованный в улучшении успеваемости студентов-химиков?
Узнайте больше о наших школьных лицензиях здесь, .
Шкала pH | Химия для неосновных
Цели обучения
- Определите pH.
- Перечислите значения pH для обычных материалов.
- Выполните расчеты pH для кислых и основных растворов.
Грейпфрутовый сок имеет pH от 2,9 до 3,3, в зависимости от конкретного продукта. Чрезмерное воздействие этого сока может вызвать эрозию зубной эмали и привести к повреждению зубов.Кислоты в грейпфрутовом соке основаны на углероде, причем лимонная кислота является одним из основных компонентов.
Это соединение имеет три ионизируемых атома водорода на каждой молекуле, которые способствуют относительно низкому pH сока.
 Другой компонент виноградного сока — яблочная кислота, содержащая два ионизируемых атома водорода на молекулу.
Другой компонент виноградного сока — яблочная кислота, содержащая два ионизируемых атома водорода на молекулу.Шкала pH
Выражение кислотности раствора с помощью молярности иона водорода затруднительно, потому что количества, как правило, очень малы.Датский ученый Сорен Соренсон (1868-1939) предложил более простую систему для индикации концентрации H + , называемую шкалой pH. Буквы pH обозначают мощность иона водорода. pH раствора — это отрицательный логарифм концентрации ионов водорода.
pH = -log [H + ]
В чистой воде или нейтральном растворе [H + ] = 1.0 × 10 -7 M. Подставляем в выражение pH:
pH = -log [1.0 × 10 -7 ] = — (- 7,00) = 7,00
Таким образом, pH чистой воды или любого нейтрального раствора составляет 7,00. В целях регистрации цифры справа от десятичной точки в значении pH являются значащими цифрами. Поскольку 1,0 × 10 -7 имеет две значащие цифры, значение pH может быть указано как 7,00.
Логарифмическая шкала сокращает диапазон кислотности до чисел, которые легко использовать. Рассмотрим решение с [H + ] = 1,0 × 10 -4 М.Это концентрация ионов водорода, которая в 1000 раз превышает концентрацию в чистой воде. PH такого раствора составляет 4,00, разница всего в 3 единицы pH. Обратите внимание, что когда [H + ] записано в экспоненциальной системе счисления и коэффициент равен 1, pH — это просто показатель степени с измененным знаком. PH раствора с [H + ] = 1 × 10 -2 M составляет 2, а pH раствора с [H + ] = 1 × 10 -10 M составляет 10.
Как мы видели ранее, раствор с [H + ] выше, чем 1,0 × 10 -7 , является кислым, в то время как раствор с [H + ] ниже, чем 1,0 × 10 -7 , является основным. . Следовательно, растворы с pH менее 7 являются кислыми, а растворы с pH выше 7 — щелочными. Рисунок 1 иллюстрирует эту взаимосвязь вместе с некоторыми примерами различных решений.
Рис. 1. Значения pH для нескольких распространенных материалов.
Расчет pH кислот и оснований
Разведение тропических рыб
Многим людям нравится иметь тропических рыбок у себя дома или на работе. На эти ярко окрашенные существа приятно смотреть, но они требуют определенного ухода, чтобы выжить.
Водопроводная вода обычно слишком щелочная, когда выходит из крана, поэтому необходимо внести некоторые изменения. Уровень pH воды будет меняться со временем, пока она находится в резервуаре, а это значит, что вам нужно время от времени проверять ее.Тогда вы станете химиком для своей рыбы.
Расчет pH кислот и оснований
Расчет pH прост, когда есть проблема 1 × 10 power . Однако в реальной жизни такое бывает редко. Если коэффициент не равен 1, необходимо использовать калькулятор для определения pH. Например, pH раствора с [H + ] = 2,3 × 10 -5 M можно найти, как показано ниже.
pH = -log [2,3 × 10 -5 ] = 4.64
Если известен pH раствора, можно рассчитать концентрацию иона водорода. Логарифм, обратный логарифму (или антилогарифм), равен 10 x на калькуляторе.
[H + ] = 10 -pH
Например, предположим, что у вас есть раствор с pH 9,14. Чтобы найти [H + ], используйте клавишу 10 x .
[H + ] = 10 -pH = 10 -9.14 = 7,24 × 10 -10 M
Концентрация гидроксид-иона и pH
Как мы видели ранее, концентрация гидроксид-иона в любом водном растворе связана с концентрацией иона водорода через значение. Мы можем использовать это соотношение для расчета pH раствора основания.
Проблема с образцом: pH основы
Гидроксид натрия — сильное основание. Найдите pH раствора, приготовленного путем растворения 1,0 г NaOH в воде, достаточной для получения 1.0 л раствора.
Шаг 1. Составьте список известных значений и спланируйте проблему .
Известный
- масса NaOH = 1,0 г
- молярная масса NaOH = 40,00 г / моль
- объем раствора = 1,0 л
- K w = 1,0 × 10 –14
Неизвестно
Сначала переведите массу NaOH в моль. Во-вторых, рассчитайте молярность раствора NaOH. Поскольку NaOH является сильным основанием и растворяется, [OH — ] будет равняться концентрации NaOH.В-третьих, используйте для вычисления [H + ] в решении. Наконец, рассчитайте pH.
Шаг 2: Решите .
Шаг 3. Подумайте о своем результате .
Раствор является щелочным, поэтому его pH больше 7. Сообщаемый pH округляется до двух десятичных знаков, поскольку исходная масса и объем имеют две значащие цифры.
Сводка
- Определено понятие pH. Перечислены значения pH
- для нескольких распространенных материалов.
- Описаны расчеты pH для кислых и основных растворов.
Практика
Прочтите материал по ссылке ниже и ответьте на следующие вопросы:
http://staff.jccc.net/pdecell/chemistry/phscale.html
- Что такое буфер?
- Насколько уксус кислотнее грейпфрута?
- Насколько мыльная вода щелочнее, чем магнезиальное молоко?
Выполните требуемые расчеты по ссылке ниже:
http: // www.sciencegeek.net/APchemistry/APtaters/pHcalculations.htm
Обзор
- Какое значение будет при использовании pH вместо молярных концентраций?
- Кофе является кислым или основным веществом?
- Если pH материала составляет 9,3, какой он кислотный или щелочной?
- Каков pH раствора 4,5 × 10 -3 M HI?
- Каков pH 3,67 × 10 -5 M раствора NaBr?
- Если у нас слабое основание с низкой константой ионизации, можем ли мы предположить, что [OH — ] в растворе равно концентрации основания?
Глоссарий
- pH: Отрицательный логарифм концентрации ионов водорода.
Шкала pH
12.6 Шкала pH
Цели обучения
- Определить pH .
- Определите pH кислотных и основных растворов.
Как мы видели, значения [H + ] и [OH — ] могут заметно отличаться от одного водного раствора к другому. Поэтому химики определили новую шкалу, которая кратко указывает концентрации любого из этих двух ионов.
pHОтрицательный логарифм концентрации ионов водорода. является логарифмической функцией [H + ]:
pH = −log [H + ]pH обычно (но не всегда) находится в диапазоне от 0 до 14. Зная зависимость pH от [H + ], мы можем резюмировать следующее:
- Если pH <7, значит раствор кислый.
- Если pH = 7, значит раствор нейтральный.
- Если pH> 7, значит раствор щелочной.
Это известно как шкала pH. Диапазон значений от 0 до 14, который описывает кислотность или основность раствора. Вы можете использовать pH, чтобы быстро определить, является ли данный водный раствор кислотным, основным или нейтральным.
Пример 12
Обозначьте каждый раствор как кислый, щелочной или нейтральный только в зависимости от указанного значения pH.
- Молоко магнезиальное, pH = 10,5
- чистая вода, pH = 7
- вино, pH = 3.0
Решение
- При pH выше 7 магнезиальное молоко является основным. (Молоко магнезии в основном состоит из Mg (OH) 2 .)
- Чистая вода с pH 7 нейтральна.
- При pH менее 7 вино кислое.
Проверьте себя
Определите каждое вещество как кислотное, основное или нейтральное, основываясь только на указанном pH.
- Кровь человека, pH = 7.4
- аммиак бытовой, pH = 11,0
- вишня, pH = 3,6
Ответы
- базовый
- базовый
- кислая
В таблице 12.3 «Типичные значения pH для различных веществ *» приведены типичные значения pH для некоторых распространенных веществ. Обратите внимание, что в списке есть несколько продуктов, и большинство из них кислые.
Таблица 12.3 Типичные значения pH различных веществ *
Вещество pH желудочная кислота 1,7 лимонный сок 2,2 уксус 2,9 содовая 3.0 вино 3,5 кофе черный 5,0 молоко 6,9 чистая вода 7,0 кровь 7,4 морская вода 8.5 Молоко магнезиальное 10,5 раствор аммиака 12,5 1,0 М NaOH 14,0 * Фактические значения могут отличаться в зависимости от условий. pH — это логарифмическая шкала . Раствор с pH 1.0 имеет в 10 раз больше [H + ] в виде раствора с pH 2,0, что, в свою очередь, имеет в 10 раз больше [H + ] в виде раствора с pH 3,0 и так далее.
Используя определение pH, также можно рассчитать [H + ] (и [OH — ]) по pH и наоборот. Общая формула для определения [H + ] по pH выглядит следующим образом:
[H + ] = 10 −pHВам необходимо определить, как вычислить указанное выше выражение на вашем калькуляторе.Спросите своего инструктора, если у вас есть какие-либо вопросы. Другой вопрос, который нас здесь беспокоит, — это значимые цифры. Поскольку число (а) перед десятичной точкой в логарифме относится к степени 10, количество цифр после десятичной точки определяет количество значащих цифр в окончательном ответе:
Пример 13
Что такое [H + ] и [OH — ] для водного раствора с pH 4,88?
Решение
Нам нужно вычислить выражение
[H + ] = 10 -4.88В зависимости от используемого калькулятора метод решения этой проблемы может быть разным. В некоторых случаях вводится «-4,88» и нажимается клавиша «10 x »; для других калькуляторов последовательность нажатия клавиш обратная. В любом случае правильный числовой ответ таков:
[H + ] = 1,3 × 10 −5 MПоскольку в 4.88 две цифры после десятичной точки, [H + ] ограничивается двумя значащими цифрами. Отсюда можно определить [OH — ]:
[ОН -] = 1 × 10–141.3 × 10−5 = 7,7 × 10−10 МПроверьте себя
Что такое [H + ] и [OH — ] для водного раствора с pH 10,36?
Ответ
[H + ] = 4,4 × 10 -11 M; [OH — ] = 2,3 × 10 −4 M
Есть более простой способ связать [H + ] и [OH — ]. Мы также можем определить pOH — отрицательный логарифм концентрации гидроксид-иона.аналогично pH:
pOH = −log [OH — ](Фактически, p «что-нибудь» определяется как отрицательный логарифм этого чего-либо.) Это также означает, что
[OH — ] = 10 -pOHПростое и полезное соотношение: для любого водного раствора
pH + pOH = 14Это соотношение упрощает определение pH по pOH или pOH по pH, а затем вычисление результирующей концентрации ионов.
Пример 14
pH раствора 8.22. Что такое pOH, [H + ] и [OH — ]?
Решение
Поскольку сумма pH и pOH равна 14, мы имеем
8,22 + pOH = 14Вычитая 8,22 из 14, получаем
рОН = 5,78Теперь мы вычисляем следующие два выражения:
[H + ] = 10 -8,22 [OH — ] = 10 -5,78Так
[H + ] = 6,0 × 10 −9 M [OH — ] = 1.7 × 10 −6 MПроверьте себя
pOH раствора 12,04. Что такое pH, [H + ] и [OH — ]?
Ответ
pH = 1,96; [H + ] = 1,1 × 10 -2 M; [OH — ] = 9,1 × 10 −13 M
Основные выводы
- pH является логарифмической функцией [H + ].
- [H + ] можно рассчитать непосредственно по pH.
- pOH связано с pH и может быть легко рассчитано по pH.
Упражнения
Определить pH . Как это связано с pOH?
Определите pOH . Как это связано с pH?
Каков диапазон pH для кислого раствора?
Каков диапазон pH для основного раствора?
Что такое [H + ] для нейтрального раствора?
Что такое [OH — ] для нейтрального раствора? Сравните свой ответ с упражнением 6.Имеет ли это смысл?
Каков pH раствора, когда [H + ] составляет 3,44 × 10 −4 M?
Каков pH раствора, когда [H + ] составляет 9,04 × 10 −13 M?
Каков pH раствора, когда [OH — ] равно 6.22 × 10 −7 M?
Каков pH раствора, когда [OH — ] составляет 0,0222 M?
Что такое pOH раствора, когда [H + ] составляет 3,44 × 10 −4 M?
Что такое pOH раствора, когда [H + ] равно 9.04 × 10 −13 M?
Что такое pOH раствора, когда [OH — ] равно 6,22 × 10 −7 M?
Что такое pOH раствора, когда [OH — ] составляет 0,0222 M?
Если раствор имеет pH 0.77, каков его pOH, [H + ] и [OH — ]?
Если раствор имеет pOH 13,09, каков его pH, [H + ] и [OH — ]?
ответов
pH является отрицательным логарифмом [H + ] и равен 14 — pOH.
Каждый вход над чистой водой кислый.
рОН = 13.23; [H + ] = 1,70 × 10 -1 M; [OH — ] = 5,89 × 10 −14 M
Расчет pH и pOH — Химия для старших классов
Если вы считаете, что контент, доступный через Веб-сайт (как определено в наших Условиях обслуживания), нарушает одно или другие ваши авторские права, сообщите нам, отправив письменное уведомление («Уведомление о нарушении»), содержащее в информацию, описанную ниже, назначенному ниже агенту.Если репетиторы университета предпримут действия в ответ на ан Уведомление о нарушении, оно предпримет добросовестную попытку связаться со стороной, которая предоставила такой контент средствами самого последнего адреса электронной почты, если таковой имеется, предоставленного такой стороной Varsity Tutors.
Ваше Уведомление о нарушении прав может быть отправлено стороне, предоставившей доступ к контенту, или третьим лицам, таким как в качестве ChillingEffects.org.
Обратите внимание, что вы будете нести ответственность за ущерб (включая расходы и гонорары адвокатов), если вы существенно искажать информацию о том, что продукт или действие нарушает ваши авторские права.Таким образом, если вы не уверены, что контент находится на Веб-сайте или по ссылке с него нарушает ваши авторские права, вам следует сначала обратиться к юристу.
Чтобы отправить уведомление, выполните следующие действия:
Вы должны включить следующее:
Физическая или электронная подпись правообладателя или лица, уполномоченного действовать от их имени; Идентификация авторских прав, которые, как утверждается, были нарушены; Описание характера и точного местонахождения контента, который, по вашему мнению, нарушает ваши авторские права, в \ достаточно подробностей, чтобы позволить репетиторам университетских школ найти и точно идентифицировать этот контент; например, мы требуем а ссылка на конкретный вопрос (а не только на название вопроса), который содержит содержание и описание к какой конкретной части вопроса — изображению, ссылке, тексту и т. д. — относится ваша жалоба; Ваше имя, адрес, номер телефона и адрес электронной почты; и Ваше заявление: (а) вы добросовестно считаете, что использование контента, который, по вашему мнению, нарушает ваши авторские права не разрешены законом, владельцем авторских прав или его агентом; (б) что все информация, содержащаяся в вашем Уведомлении о нарушении, является точной, и (c) под страхом наказания за лжесвидетельство, что вы либо владелец авторских прав, либо лицо, уполномоченное действовать от их имени.
Отправьте жалобу нашему уполномоченному агенту по адресу:
Чарльз Кон Varsity Tutors LLC
101 S. Hanley Rd, Suite 300
St. Louis, MO 63105Или заполните форму ниже:
Метод анализа pH и щелочности
Проект ARM На главную | Информация для волонтеров | Результат
pH и щелочность
Метод отбора проб из озера — Метод отбора проб из реки — Протоколы анализа — Техническое обслуживание pH-электрода
** Для масс.СОП, утвержденный Департаментом охраны окружающей среды, получите файл в формате pdf для озер или рек **
Справочная информация
pH — это мера концентрации водородных ионов в воде по шкале от 1,0 до 14,0. Чем ниже pH воды, тем она более кислая. Чем выше pH воды, тем она более щелочная или щелочная. pH влияет на многие химические и биологические процессы в воде, и разные организмы имеют разные диапазоны pH, в которых они процветают.Большинство водных животных предпочитают диапазон pH от 6,5 до 8,0. pH за пределами этого диапазона снижает разнообразие в потоке, потому что он оказывает стрессовое воздействие на физиологические системы большинства организмов и может снизить воспроизводство. Низкий pH также может позволить токсичным элементам и соединениям, таким как тяжелые металлы, стать подвижными и «доступными» для поглощения водными растениями и животными. Опять же, это может создать условия, токсичные для водных организмов, особенно для таких чувствительных видов, как форель.
Изменения кислотности могут быть вызваны атмосферным выпадением (кислотный дождь или кислотный шок от таяния снега), окружающими породами и сбросами сточных вод.Технически шкала pH измеряет логарифмическую концентрацию ионов водорода (H +) и гидроксида (OH-), которые составляют воду (H + + OH- = h30). Когда оба типа ионов находятся в равной концентрации, pH равен 7,0 или нейтрален. Ниже 7,0 вода кислая (ионов водорода больше, чем ионов гидроксида). Когда pH выше 7,0, вода щелочная или щелочная (гидроксид-ионов больше, чем ионов водорода). Поскольку шкала логарифмическая, снижение pH на 1,0 означает 10-кратное увеличение кислотности.Таким образом, образец воды с pH 5,0 в десять раз более кислый, чем образец с pH 6,0. pH 4,0 в 100 раз кислотнее pH 6,0.
Щелочность — это показатель «буферной способности» реки или ее способности нейтрализовать кислоты. Щелочные соединения в воде, такие как бикарбонаты (пищевая сода — один из видов), карбонаты и гидроксиды, удаляют ионы H + и снижают кислотность воды (что означает повышение pH). Обычно они делают это путем объединения с ионами H + для создания новых соединений.Без этой способности нейтрализовать кислоту любая кислота, добавленная в реку, вызовет немедленное изменение pH. Измерение щелочности важно для определения способности реки нейтрализовать кислотное загрязнение (измеряемое по pH) в результате дождя или таяния снега. Это один из лучших показателей чувствительности реки к поступлению кислоты. Щелочность возникает из-за горных пород и почв, солей, определенных видов деятельности растений и некоторых сбросов промышленных сточных вод. Общая щелочность измеряется путем отбора пробы воды и измерения количества кислоты, необходимой для доведения pH пробы до 4.2. При этом pH все щелочные соединения в образце «израсходованы». Результат выражается в миллиграммах на литр (мг / л) карбоната кальция.
В рамках проекта мониторинга кислотных дождей в Массачусетсе воды классифицируются по щелочности следующим образом:
<0 * мг / л: Подкисленный > 5-10 мг / л: высокочувствительный > 0-2 мг / л: критический > 10-20 мг / л: чувствительный > 2-5 мг / л: под угрозой исчезновения > 20 мг / л: не чувствительно * и pH менее 5.0.
Метод отбора проб озер
Полевое оборудование
- Бутыль для проб из полиэтилена высокой плотности, 500 мл
- Полевой технический паспорт
- Кулер и колит или лед
- Сумка на молнии (размер 1 галлон)
Метод
Примечание: Положите в холодильник достаточно льда или аналогичного количества, чтобы как можно скорее снизить температуру пробы до 4 ° C.
Метод отбора проб для рек
Полевое оборудование
- Бутыль для проб из полиэтилена высокой плотности, 500 мл
- Полевой технический паспорт
- Кулер и колит или лед
- Сумка на молнии (размер 1 галлон)
Протокол отбора проб
Пробы следует брать из проточной воды.Вода должна быть глубже бутылок для образцов, и на ней не должно быть накипи и мусора. Если вода на вашем обычном месте отбора проб недостаточно глубока, поищите поблизости другое место, которое в равной степени репрезентативно для этого места, но глубже. Если его нет, не собирайте образец и укажите на своем полевом листе, что уровень воды слишком низкий. Обратите внимание, что отбор проб из стримбанка не рекомендуется, так как это может привести к нерепрезентативным пробам.
Осторожно войти в ручей, поднимаясь вверх по течению, избегая взбалтывания донных отложений.Перед взятием пробы дождитесь, пока не вернутся условия, предшествующие возмущению (из-за перехода вброд). Если вы плывете в каноэ, попросите вашего партнера удерживать его.
Если возможно, возьмите пробу в середине потока. В противном случае отойдите от берега как можно дальше от берега. Пройдите вверх по течению и соберите пробу так, чтобы вы не стояли и не плыли перед бутылкой.
Откройте крышку пробоотборника и трижды промойте речной водой: частично наполните бутылку, закройте крышку, встряхните и опорожните вниз по течению.
Для взятия пробы полностью погрузите бутыль под воду, наполнив до перелива.
Закройте бутылку крышкой, пока она находится под водой, чтобы удалить воздух из емкости для проб.
Вернитесь на берег и поместите образец в холодильник со льдом.
Заполните сразу полностью лист реки, указав «pH / ANC» в столбце «Химия»
Начало страницы
Метод анализа
Измерение pH
Требуемое оборудование:
- pH-метр
- Буферы (4.01 и 7.00)
- Вода деионизированная или дистиллированная
- Стеклянный стакан 150 мл
- Магнитная мешалка
- Мешалка
- Градуированный цилиндр на 100 мл (опция для измерения pH)
После калибровки глюкометра с помощью буферов промойте электрод (ы) и стеклянную посуду дистиллированной или деионизированной водой.Тщательно отмерьте 100 мл образца и поместите в стакан на 150 мл для определения pH и щелочности. Поместите промытый электрод в исследуемый образец. Мы настоятельно рекомендуем перед анализом дать всем образцам нагреться до комнатной температуры в плотно закрытой бутылке. Если вы проводите другие анализы с пробой воды, имейте в виду, что pH следует анализировать в течение 5 минут после открытия бутылки с пробой. Образец следует очень осторожно перемешивать, желательно магнитной мешалкой. Для стабилизации показаний может потребоваться до 3 минут.После стабилизации, но не более 5 минут, запишите pH пробы с точностью до 0,01 единицы pH
Измерение щелочности
Требуемое оборудование:
- pH-метр
- Электрод многоразового использования
- Буферы (4.01 и 7.00)
- Вода деионизированная или дистиллированная
- Стеклянный стакан 150 мл
- Магнитная мешалка
- Мешалка
- Градуированный цилиндр 100 мл
- Цифровой титратор
- Картридж с серной кислотой 0,16N
После установки картриджа с серной кислотой на место в цифровом титраторе Hach обязательно перемещайте поршень вручную до тех пор, пока титрант не выйдет из выпускного наконечника.Сделайте это, как если бы вы использовали шприц для подкожных инъекций, с поднятым наконечником для удаления пузырьков. Убери все пузыри! Затем продвигайте поршень, используя ручку подачи на конце титратора, до тех пор, пока вы не будете уверены, что наконечник подачи заполнен раствором. Убедитесь в отсутствии утечек в месте соединения наконечника с картриджем. Хорошо промойте наконечник дистиллированной водой или образцом; это важно, потому что титрант концентрированный и немного помогает. Сбросьте счетчик на ноль, и вы готовы к титрованию.
После завершения титрования и записи количества использованного титранта промойте наконечник выдачи дистиллированной водой или следующей пробой, сбросьте счетчик (ЭТО ЛЕГКО ЗАБЫТЬ, КОГДА ЗАНЯТ), и вы сразу готовы к следующей пробе.
Титрование проходит лучше, если наконечник подачи находится под поверхностью титруемого раствора. Для одного или двух образцов титратор можно держать в руке, однако его легче закрепить на кольцевой стойке с помощью зажима.Старайтесь держать титратор вертикально во время всех титрований; размещение титратора горизонтально на столе между титрованием может привести к появлению пузырьков в наконечнике.
Поставляемые картриджи с кислотой содержат 0,16N серную кислоту. Наши воды, как правило, имеют довольно низкую щелочность, поэтому мы используем специальную процедуру определения щелочности по двойной конечной точке, чтобы точно измерить щелочность ниже 20 мг / л.
После считывания и записи pH, как описано выше, титруйте
с цифровым титратором и картриджем с серной кислотой до pH 4.5; записать использованный титрант как A. Продолжайте титрование до pH 4,2. Запишите титрант, использованный до этой точки, как B. Если начальное значение pH меньше 4,5, запишите начальное значение pH. Титровать до тех пор, пока pH не станет на 0,3 единицы ниже начальной точки. Введите цифры титранта, используемые как B; A = 0. Запишите значение pH, на котором вы остановились (для проверки точности). Мы будем использовать компьютеры для расчета щелочности, но вы можете сделать свои собственные расчеты, используя приведенные ниже формулы. Примеры помогут прояснить, какие формулы могут несколько запутать.
A = цифры, используемые для pH 4,5
B = цифры, используемые для pH на 4,2 или 0,3 единицы pH ниже начального значения (общий титрант, включая A)
Двойная конечная щелочность = (2A — B) x 0,1ПРИМЕР: Образцу требуется 120 цифр для достижения pH 4,5. Для достижения pH 4,2 потребовалось еще 15 цифр, всего 135 цифр. Следовательно, A = 120 и B = 135.
Двойная конечная щелочность = (240 — 135) x 0,1 = 10,5 мг / лПРИМЕР: Образец имел исходное значение pH 4.3. Для понижения pH до 4,0 в образце требовалось 22 цифры. Следовательно, A = 0; B = 22.
Двойная конечная щелочность = (0-22) x 0,1 = -2,2 мг / лХотя может показаться, что отрицательное значение щелочности не имеет большого смысла, это чрезвычайно важный показатель для оценки подкисления.
Уход и обслуживание pH-электрода
Общие процедуры ухода за электродами и обращения с ними очень важны в вашей лаборатории, потому что измерения pH будут соответствовать состоянию вашего электрода (-ов).Для большей точности измерений и увеличения срока службы электродов существует несколько областей ухода за электродами, с которыми вам следует ознакомиться.
ХранилищеСтеклянные комбинированные или отдельные электроды pH и сравнения должны оставаться влажными. Эталонный электрод требует сыпучего соединения, так что для поддержания раствора опорного заполнения на уровне, значительно выше хранения или образец уровня раствора во все времена Это позволит обеспечить положительное давление головки, которое силой начинки раствора через стык вместо раствора для хранения в зонд.
Для сухого хранения гильза или заглушка должны закрывать заливное отверстие, чтобы уменьшить поток заполняющего раствора. Однако во время измерения или хранения в буфере с pH 4 эту втулку или заглушку необходимо сдвинуть или снять, чтобы раствор сравнения попал в образец.
Для получения более быстрого отклика электрода стеклянный электрод следует хранить в слабокислом растворе. В защитный колпачок стеклянного электрода нанесите одну или две капли буфера с pH 4 и осторожно наденьте колпачок на электрод.Дистиллированная вода извлекает ионы из колбы, вызывая более медленную реакцию; Буфер pH 7 в течение длительного периода времени слегка стареет электрод.
При использовании отдельного электрода сравнения лучшим решением было бы поместить электрод сравнения в его собственный заполняющий раствор, но это может привести к беспорядку. Подача KCl по обеим сторонам соединения делает его более свободным. Чтобы уменьшить солевую корку насыщенного раствора, можно использовать примерно 0,1 М раствор KCl, но только для хранения.Опыт показывает, что в большинстве случаев достаточно просто закрыть заливное отверстие защитным кожухом и хранить в сухом виде при соблюдении процедуры замачивания.
Для комбинированных электродов храните электрод в комбинированном растворе приблизительно 0,1 М KCl в буфере с pH 4.
За день или более до анализа погрузите оба электрода в буфер с pH 4 и во время анализа поместите электроды в тот же буфер, когда они не используются.
Раствор для заполнения электрода сравненияВнимательно прочтите инструкции, прилагаемые к электродам.Насыщенные каломельные электроды сравнения, такие как те, которые используются в проекте мониторинга кислотных дождей, должны быть заполнены , а не заполняющими растворами, содержащими хлорид серебра (AgCl). Мы используем только растворы 4M KCl. Однако наиболее распространенным раствором для заполнения комбинированных электродов является 4 M KCl, насыщенный AgCl. Убедитесь, что вы выбрали правильный заливочный раствор для вашего электрода (-ов), и дважды проверьте, соответствует ли ваш заливочный раствор этим требованиям.
Постоянно заполненные или гелевые электроды Из-за их уникального микропористого перехода рекомендуется хранить их в сухом виде.
Предварительное испытание отклика электродаЕсли ваш электрод показывает медленный отклик, недостаточный интервал между двумя значениями буфера или чрезмерную чувствительность к перемещению электрода, для улучшения характеристик может потребоваться омоложение.
Отклик зависит от электрода и раствора, в котором он находится. Обычно рабочие электроды достигают 0,05 единиц pH от конечного значения в буфере в течение 10 секунд. Стабильное показание (изменение менее 0,01 единицы pH в минуту) должно быть достигнуто в пробах пресной воды в течение одной или двух минут.Если вам придется ждать слишком долго (5 минут или больше), то сам pH может измениться из-за контакта пробы воды с воздухом.
Для электродовможет также потребоваться регулировка наклона до значений, значительно отличающихся от 100% для калибровки по двум точкам. Если есть сомнения, выполните следующий тест:
Установите для глюкометра наклон 100% и комнатную температуру, затем выполните стандартизацию, как обычно, с помощью буфера pH 7. Не перемещая шкалу крутизны, считайте буфер pH 4. Оно должно быть от 3,85 до 4.15; установите наклон на pH 4, наклон должен составлять от 95% до 105%.
Если ваш электрод демонстрирует одну из вышеперечисленных проблем или чувствителен к движению, следует провести омоложение.
Омоложение стеклянным электродомДля обработки колбы электрода pH:
Используйте по 1 флакону кислоты и основания (0,1 н.).
БУДЬТЕ ОСТОРОЖНЫ ПРИ ОБРАЩЕНИИ С ЭТИМИ РЕШЕНИЯМИ. ЕСЛИ ВЫ ПОЛУЧИТЕ КАКИЕ-ЛИБО, СМЫЙТЕ БОЛЬШОЙ ВОДОЙ.
- Окуните грушу электрода в кислоту и подождите, пока измеритель не покажет pH ~ 1
- Промойте электрод, затем погрузите в основание.Подождите, пока глюкометр не покажет pH ~ 13
- Повторите этот цикл ополаскивания и окунания несколько раз (минимум 3 раза, лучше 6 раз)
- Для последнего цикла вы можете оставить электрод в базе на 5 минут, затем ненадолго в кислоте, пока pH не достигнет ~ 1
- Затем промойте электрод водопроводной водой и оставьте на 2 часа в буфере с pH 4.
- Промойте электроды и повторно откалибруйте глюкометр, как вы обычно делаете с буферами pH 7 и pH 4.
Для обработки электрода сравнения:
Замените 4M раствор KCl в электроде сравнения и избавьтесь от кристаллов, которые могли образоваться.Если кристаллов много, встряхните раствор, налейте деионизированную чистую воду в заливное отверстие и погрузите кончик электрода в горячую водопроводную воду примерно на 15 минут, пока кристаллы не растворятся. Затем вытряхните всю жидкость из заливного отверстия электрода сравнения и снова залейте свежим 4 M KCl. Перед использованием дайте электроду постоять при комнатной температуре на полчаса. Часто добавляйте больше 4M раствора KCl к электроду сравнения, так как он будет постоянно вытекать и испаряться. Раствор в электроде должен находиться в пределах ½ дюйма от заливного отверстия.Отверстие должно быть открытым при считывании pH, но закрывать его, когда вы закончите в течение дня, иначе раствор испарится и образуются новые кристаллы (но не закрывайте отверстие, если вы будете хранить электрод в растворе с pH 4). Если у вас все еще есть проблемы с медленным откликом, попробуйте потереть кончиком синие джинсы или очень мелкую (зернистость 600) наждачную бумагу.
Для комбинированных электродов выполните обе процедуры, описанные выше.
Заключительный тест на линейностьСтандартизируйте счетчик, как описано ниже.Промойте электроды и чашку для образцов чистой деионизированной водой. Затем оттитруйте 100,0 мл деионизированной воды 0,16N кислотой следующим образом: Убедитесь, что ваш цифровой титратор работает, и сбросьте его до нуля. Добавьте 10 цифр кислоты, запишите цифры и pH, увеличьте кислотность до 20 цифр, запишите pH; повторяйте, пока не добавите 100 цифр кислоты, и остановитесь. Отправьте нам результаты, и мы отправим вам отчет. Если вы хотите увидеть результаты самостоятельно, попробуйте построить график зависимости концентрации ионов водорода (H = 10 (-pH)) отцифры и посмотрите, прямая ли линия.
Чувствительность движенияЕсли ваш глюкометр дает дикие показания и чувствителен к прикосновениям, возможно, он не заземлен. Попробуйте использовать трехконтактную вилку или подсоедините провод от счетчика к трубе с холодной водой. Иногда проблему колебания или непротиворечивости показаний можно решить, отсоединив и повторно подключив электродные соединители несколько раз. Очевидно, оксидный слой иногда может вызывать эти симптомы.
КалибровкаpH-метр следует стандартизировать (откалибровать) перед анализом пробы и после каждых 25 анализов проб. Буферы должны быть комнатной температуры (68 ° F). Удалите электроды из буферного раствора с pH 4, в котором они пропитались не менее одного дня. Промыть деионизированной водой. Вставьте электроды в буферный раствор с pH 7,00 и поверните шкалу калибровки до тех пор, пока на глюкометре не будет точно pH 7,00. Снимите электроды и промойте деионизированной водой.Поместите электроды в буфер с pH 4,01 и отрегулируйте наклон до тех пор, пока измеритель не покажет pH 4,01. Промыть деионизированной водой.
Примечание по буферам . Точность измерения pH напрямую зависит от точности стандартного буферного раствора, используемого для калибровки вашего pH-метра. Чтобы поддерживать разумную степень точности при измерении pH, следует соблюдать ряд мер предосторожности, касающихся ухода за буферами и их использования. К ним относятся:
1.Не используйте буферы по истечении срока их годности. Рост плесени, абсорбция CO2 и загрязнение вызывают изменения pH буферного раствора.
Значения буфера при различных температурах
2. Не используйте буферы, в которых есть плесень.
3. Всегда закрывайте емкость с буфером при хранении, чтобы предотвратить загрязнение и уменьшить поглощение CO2.
4. Значения pH-буфера меняются в зависимости от температуры. Обязательно измерьте температуру буфера и найдите его значение при этой температуре перед стандартизацией измерителя (см. Ниже).
5. Не наливайте использованный буфер обратно в бутыль.
pH и щелочность QA / QCТемпература Буферы ° С ° F pH 4 pH 7 0 32 4,003 7,119 5 41 3,998 7.086 10 50 3.996 7.058 15 59 3,996 7.035 20 68 3,999 7.015 25 77 4,004 7.000 30 86 4,011 6,998 Контроль качества pH и щелочности состоит из нормального измерения pH и титрования образца, подготовленного WRRC и отправленного вам перед сбором на месте.Таких образцов будет три. За несколько дней до отбора проб вы получите от нас первый образец QA / QC вместе с открыткой для отчета о ваших результатах. Это диагностический образец. Следуйте процедурам, описанным для измерения pH и щелочности. Проанализируйте две отдельные аликвоты этого образца и сообщите нам о своих результатах на открытке. Вам позвонят, если мы обнаружим существенное несоответствие между нашими ожиданиями и вашими измерениями. Мы будем работать с вами, чтобы устранить проблему, чтобы вы были уверены в качестве анализа полевых проб.Два других образца QA / QC будут доставлены непосредственно перед отбором образцов в полевых условиях. В отличие от первой выборки QA / QC, они используются для документирования качества данных, помогая нам статистически определять точность и точность вашего анализа. Проанализируйте две отдельные аликвоты одной из них непосредственно перед измерением pH и щелочности полевых проб; проанализируйте две отдельные аликвоты второй пробы QA / QC сразу после анализа полевых проб. Другими словами, первые два анализируемых образца должны быть из одной из бутылей QA / QC, затем проанализировать полевые пробы и, наконец, проанализировать две пробы из другой бутылки QA / QC.Результаты должны быть указаны в паспорте лаборатории pH и щелочности.
Начало страницы
. - Covington, A.K .; Bates, R.G .; Дерст, Р. А. (1985).

 -] = 1.{-14} \)
-] = 1.{-14} \) +] = Ион \]
+] = Ион \] -] [B +]} {[B]} \) и таблица ICE.
-] [B +]} {[B]} \) и таблица ICE. См. Это химическое уравнение ниже.
См. Это химическое уравнение ниже. Этот расчет легко выполнить на любом научном калькуляторе, потому что чаще всего на нем есть кнопка «журнал». Это не то же самое, что кнопка «ln», которая относится к натуральному логарифму.
Этот расчет легко выполнить на любом научном калькуляторе, потому что чаще всего на нем есть кнопка «журнал». Это не то же самое, что кнопка «ln», которая относится к натуральному логарифму.
 «Определения шкал pH, стандартных эталонных значений, измерения pH и соответствующей терминологии». Pure Appl. Chem . 57 (3): 531–542. DOI: 10.1351 / pac198557030531
«Определения шкал pH, стандартных эталонных значений, измерения pH и соответствующей терминологии». Pure Appl. Chem . 57 (3): 531–542. DOI: 10.1351 / pac198557030531
 Раствор с pH менее 7 — это кислота, ровно 7 — нейтральный раствор, а более 7 — основание. Основания содержат меньше ионов водорода, но больше гидроксид-ионов, представленных pOH или «потенциалом гидроксид-ионов».
Раствор с pH менее 7 — это кислота, ровно 7 — нейтральный раствор, а более 7 — основание. Основания содержат меньше ионов водорода, но больше гидроксид-ионов, представленных pOH или «потенциалом гидроксид-ионов». Основания, согласно этой логике, являются акцепторами протонов. Основания, несущие неподеленные пары электронов, притягивают положительные ионы водорода (протоны).
Основания, согласно этой логике, являются акцепторами протонов. Основания, несущие неподеленные пары электронов, притягивают положительные ионы водорода (протоны).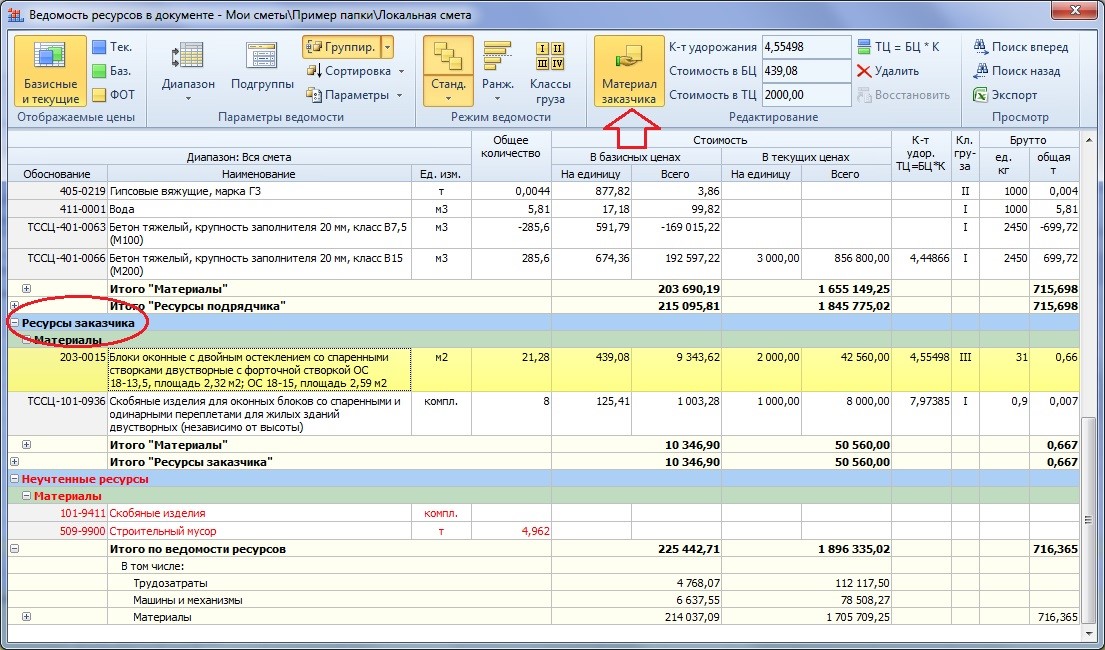 Высокое количество растворенного вещества соответствует высокой концентрации, а меньшее количество растворенного вещества соответствует низкой общей концентрации.
Высокое количество растворенного вещества соответствует высокой концентрации, а меньшее количество растворенного вещества соответствует низкой общей концентрации.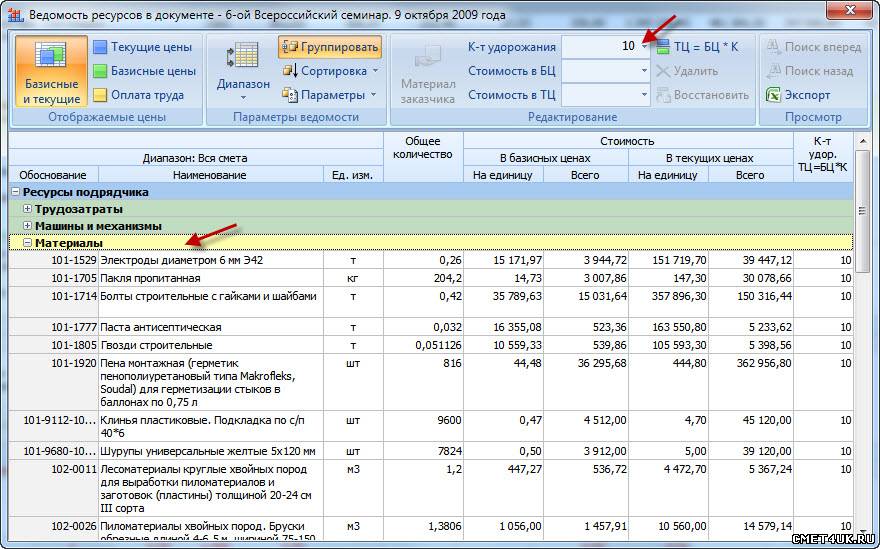 Высокая концентрация OH — , соответствующая низкой концентрации H + , является свойством основного раствора.
Высокая концентрация OH — , соответствующая низкой концентрации H + , является свойством основного раствора.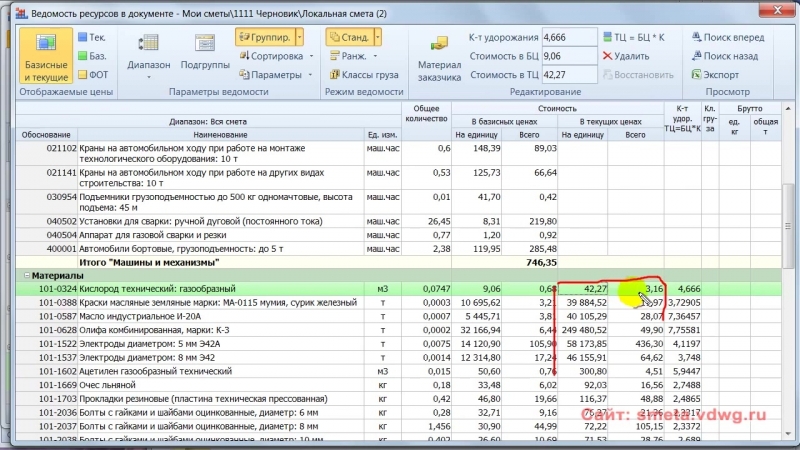 {+} right]} = log (0.100) = 1,00
{+} right]} = log (0.100) = 1,00 {-12}
{-12}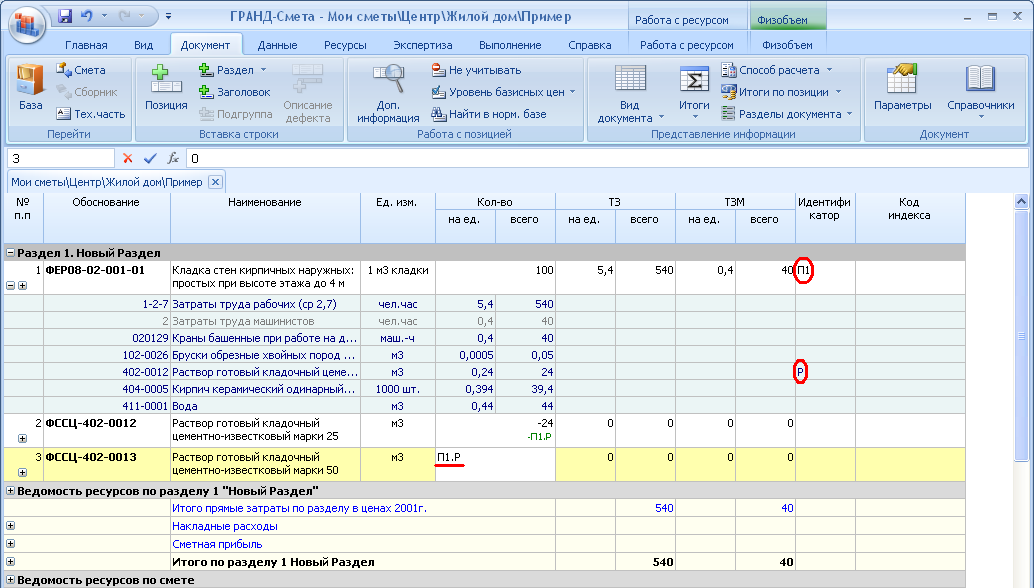
 Конкретные значения pH имеют жизненно важное значение для таких растворов, как слюна, желудочная кислота и кровь. Выработка слюны во рту называется первым этапом пищеварения.Во всем пищеварительном тракте пища должна расщепляться кислыми растворами. Для начала этого процесса важно, чтобы pH слюны был в пределах 6,5-7,5, слегка кислый. Позже желудочная кислота также действует в пищеварительной системе. Важно, чтобы желудочная кислота имела очень кислый pH в диапазоне от 1,5 до 3,5 из-за секреции HCl и высокой концентрации ионов водорода. Эта сильнокислая среда ускоряет пищеварение и начинает расщеплять частицы пищи, готовясь к процессу выделения.
Конкретные значения pH имеют жизненно важное значение для таких растворов, как слюна, желудочная кислота и кровь. Выработка слюны во рту называется первым этапом пищеварения.Во всем пищеварительном тракте пища должна расщепляться кислыми растворами. Для начала этого процесса важно, чтобы pH слюны был в пределах 6,5-7,5, слегка кислый. Позже желудочная кислота также действует в пищеварительной системе. Важно, чтобы желудочная кислота имела очень кислый pH в диапазоне от 1,5 до 3,5 из-за секреции HCl и высокой концентрации ионов водорода. Эта сильнокислая среда ускоряет пищеварение и начинает расщеплять частицы пищи, готовясь к процессу выделения.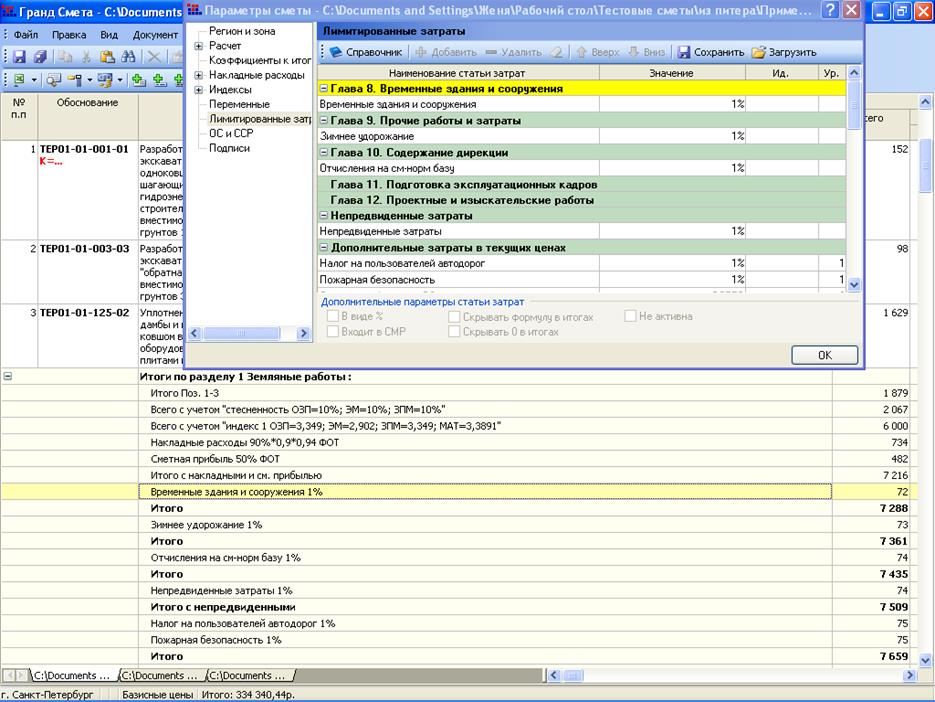
 Мы зададим вам сложные практические вопросы, которые помогут вам достичь мастерства в химии.
Мы зададим вам сложные практические вопросы, которые помогут вам достичь мастерства в химии.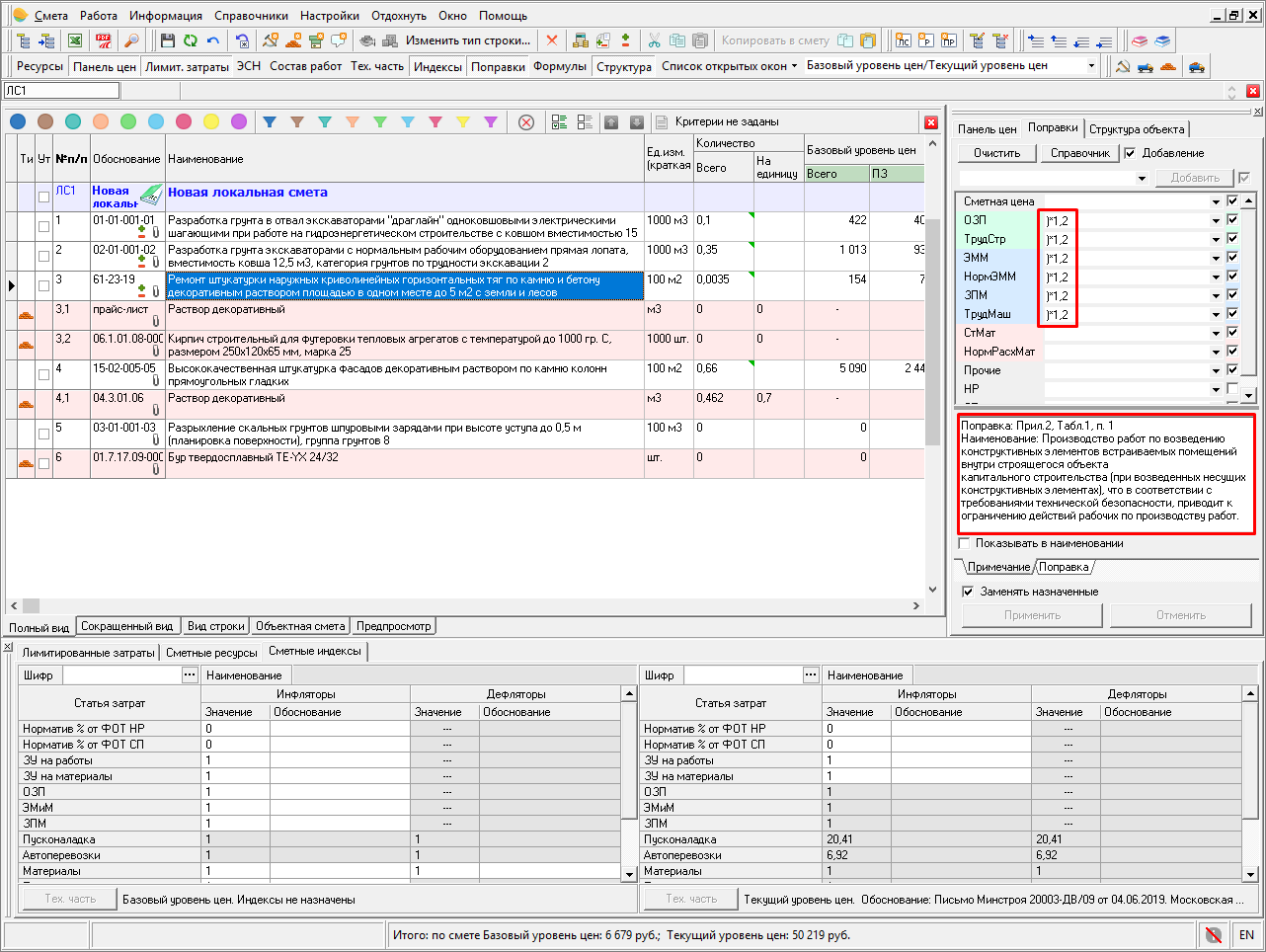 Другой компонент виноградного сока — яблочная кислота, содержащая два ионизируемых атома водорода на молекулу.
Другой компонент виноградного сока — яблочная кислота, содержащая два ионизируемых атома водорода на молекулу.